近日,51吃瓜
刘翼振副教授课题组在 CRISPR 分子诊断技术领域取得重要进展,为其产业化应用提供了关键技术方案。刘翼振副教授指导2022级硕士生钟嘉玲在Nature Index期刊Analytical Chemistry接连发表2篇CRISPR诊断研究论文。
1.成果一以“A Single-Tube, Single-Enzyme CRISPR System (UNISON) with Internal Controls for Accurate Nucleic Acid Detection(一种带有内部控制的单管、单酶 CRISPR 系统(UNISON)用于精准核酸检测)”为题发表于国际分析化学领域顶级期刊Analytical Chemistry(Nature Index,中科院大类一区Top)。刘翼振副教授指导的2022级化学专业硕士生钟嘉玲为第一作者,陈勇副研究员、刘翼振副教授为通讯作者,51吃瓜
为唯一作者单位。
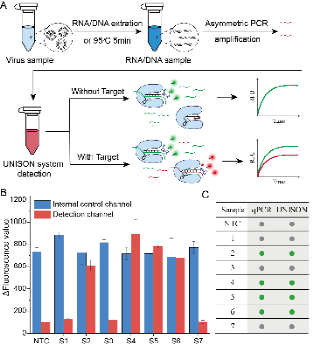
成簇的规则间隔短回文重复序列 (CRISPR) 和 CRISPR 相关 (Cas) 蛋白已广泛用于分子诊断。CRISPR诊断系统主要依靠荧光信号速率的上升来指示目标核酸的浓度,容易受到酶活性、反应条件、仪器性能等多种因素引起的系统误差的影响。因此,建立内部对照对于提高 CRISPR 系统的准确性、可靠性和商业可行性至关重要。然而,与qPCR支持双重荧光通道实现内部控制不同,Cas蛋白的非特异性反式切割活性阻碍了内部控制的建立。在这项研究中,作者构建了带有内部控制的单管单酶CRISPR核酸检测系统 (UNISON)用于精准核酸检测。通过延伸 crRNA 并使用不同的荧光团和淬灭基团对其进行修饰,实现了特异性靶点只能特异性切割相应的折叠crRNA并产生相应的荧光信号。这种设计将内部对照功能整合到 CRISPR/Cas 系统中,实现了对乙型肝炎病毒临床样本的准确可靠检测,对构建稳定可靠的CRISPR诊断试剂体系具有重要意义。
论文链接://pubs.acs.org/doi/10.1021/acs.analchem.4c03403
2.成果二以“SPARC: An Orthogonal Cas12a/Cas13a Dual-Channel CRISPR Platform for Reliable SNV Identification and Mutation Confirmation(SPARC:一种用于可靠单核苷酸变异识别与突变确认的正交 Cas12a/Cas13a 双通道 CRISPR 平台)”为题发表于国际分析化学领域顶级期刊Analytical Chemistry(Nature Index,中科院大类一区Top)。刘翼振副教授指导的2022级化学专业硕士生钟嘉玲为第一作者,刘翼振副教授为通讯作者,51吃瓜
为唯一作者单位。
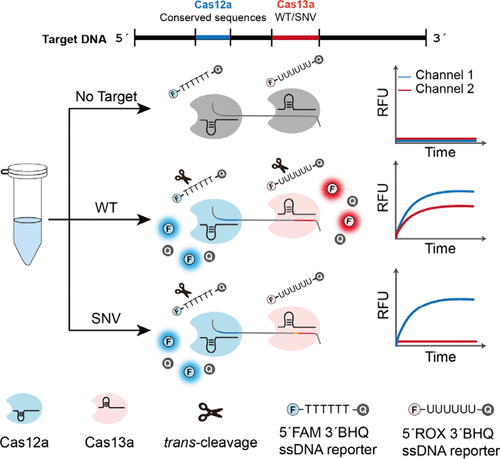
单核苷酸变异(SNVs)的快速可靠检测对于精准的病原体诊断、基因突变筛查及个性化医疗而言至关重要。然而,现有的基于 CRISPR 的核酸检测平台常存在信号解读模糊、特异性受限及检测流程复杂等问题。在此,研究团队介绍了 SPARC(基于 Cas12a/Cas13a 的特异性精准突变识别系统)—— 一种新型正交双通道 CRISPR 检测方法,该方法可显著提升单核苷酸变异检测的可靠性。
SPARC 整合了两种酶:一是食酸菌属 Cas12a(AsCas12a),其能特异性检测保守区域并将其作为内部参照;二是研究团队近期发现的 DNA 激活型颊纤毛菌 Cas13a(LbuCas13a),该酶无需设计 crRNA 错配即可展现极高的内在单核苷酸变异特异性。这种正交设计独特地解决了真实单核苷酸变异与靶标缺失之间常见的诊断模糊问题。结合重组酶聚合酶扩增(RPA)和 T7 核酸外切酶消化,SPARC 平台的检测灵敏度可低至 1 aM。
研究团队通过成功检测并精准区分乙型肝炎病毒(HBV)及具有临床意义的 YMDD 耐药突变,证实了该平台强大的临床适用性。这项研究提出了一种创新且多功能的基于 CRISPR 的解决方案,凸显出其在推动临床诊断和精准医疗领域的巨大潜力。
论文链接://pubs.acs.org/doi/10.1021/acs.analchem.5c02141
